新型コロナウイルス患者の重症化を防ぐ飲み薬の開発を、塩野義製薬が進めている。近く厚生労働省に承認申請をする方針で、臨床試験(治験)全てを終えなくても薬を使える「条件付き早期承認」を目指すという。国産治療薬への期待の一方、「治験の症例数が少なすぎ、副作用のリスクがはっきりしない」と懸念の声も上がる。(森耕一)
◆感染初期に服用、重症化阻止狙う
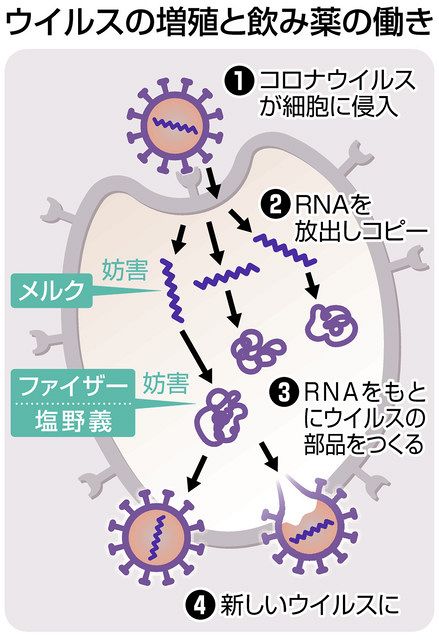
「優れた有効性、安全性のトレンドが確認できております」。塩野義は7日の投資家らへの説明会で、開発中の新薬への自信を示した。新薬は、ウイルスが人の細胞内で増殖するための部品となるタンパク質をつくることを妨げる「抗ウイルス薬」。感染初期に服用することで、重症化阻止を狙う。
抗ウイルス薬としては、米国で緊急使用許可が出た米メルクのモルヌピラビル、米ファイザーのパキロビッドの2つが、国内で特例承認されている。
重症患者らの治療に当たるかわぐち心臓呼吸器病院(埼玉県川口市)の竹田晋浩理事長は、高齢者施設でクラスター(感染者集団)が発生したケースなどでモルヌピラビルを処方した。「死者は出なかった。効いているのかなという感触は持っている」と話す。
ただし、モルヌピラビルもパキロビッドも重症化リスクの高い人が対象だ。竹田氏は「インフルエンザで処方するタミフルのように、新型コロナ陽性の人の多くに、すぐ渡せる飲み薬があることが望ましい」と新薬の登場を期待する。
塩野義は開発中の飲み薬について、高齢であることや基礎疾患の有無などの「リスク因子は関係ない」と説明する。無症状や軽症、中等症の感染者が対象となる。
◆承認急ぐ政府、「治験対象少ない」と識者
気がかりは、治験の症例数の少なさ。塩野義が7日に「有効性、安全性のトレンドが確認」と説明した際、公表したのは69人の治験データだった。
製薬業界に詳しい専修大の高橋義仁教授は「薬の思いもしない副作用のリスク確認のために臨床試験の制度がある。69人の治験では100人に1人に現れる副作用も見つからない可能性があり、とても安全性が示された状況ではない」と疑問を呈する。
パキロビッドとモルヌピラビルの米国での治験は、それぞれ、2000人、1400人規模で行われた。塩野義も7月までに2000人規模の治験を行う計画だが、まずは400人分の治験データを先行して提出して承認申請をすることになりそう。
そうした塩野義の動きに政府は前向きだ。岸田文雄首相は7日の衆院予算委員会で、「臨床試験で安全性・有効性が示された場合には、条件付き承認制度も含め、あらゆる手法の活用を視野に迅速に審査を行いたい」と話した。
だが、条件付きの承認制度は本来、患者が極めて少なく大規模治験が難しい希少がんなどの治療薬を実用化するためのもの。もともと、大勢が服用する薬を想定していない。
米国で公衆衛生などを研究する木下喬弘医師は「多くの人への飲み薬を目指すのなら治験対象が400人でも少ない。これで承認すると、日本の薬事承認が世界から信頼されなくなる。もう数カ月かかっても、しっかり治験をした方がいい」と訴える。
関連キーワード
おすすめ情報
からの記事と詳細 ( 塩野義のコロナ新飲み薬に高まる期待…まだ安全性ははっきりせず 治験終える前に早期承認を目指す - 東京新聞 )
https://ift.tt/jnXx28B

No comments:
Post a Comment